Інструкція до вакцини проти пандемічного грипу Arepanrix™ H1N1 з ад'ювантом AS03
Інформація про продукт: Вакцина Arepanrix™ H1N1 з ад'ювантом AS03 проти пандемічного грипу, що призначена для використання в Канаді.
Ця вакцина разом з російською "МоноГриппол Нео" проходить процедуру реєстрації для масового використання в Україні.
Коментарі перекладача та ГО "Ліга захисту громадянських прав" з цього приводу див. нижче.
Міністерство охорони здоров'я Канади дозволило продаж вакцини Arepanrix™ H1N1 на основі обмежених клінічних випробувань на людях у відповідності до положень Тимчасового Порядку, оприлюдненого 13 жовтня 2009 року. Дозвіл базується на вивченні МОЗ Канади наявної інформації про її якість, безпечність та імуногенність. З огляду на поточну загрозу пандемії та її ризик для здоров'я людей, МОЗ Канади вважає співвідношення переваг та ризику від вакцини Arepanrix™ H1N1 прийнятним для активної імунізації проти штаму грипу H1N1 2009 в умовах офіційно оголошеної пандемічної ситуації.
У рамках дозволу на продаж Arepanrix™ H1N1 МОЗ Канади вимагає від ініціатора постмаркетингових зобов'язань. Виконання цих зобов'язань та оновлення інформації про якість, неклінічних та клінічних даних постійно моніторитиметься МОЗ Канади та Агентством Суспільної Охорони Здоров'я Канади.
Ця інформація була підготовлена компанією GlaxoSmithKline Inc. для фахівців охорони здоров'я, споживачів та інших зацікавлених сторін.
Редакція 1, затверджено 21 жовтня 2009
Ця брошура буде відповідно оновлюватися.
Зверніться на сайт Міністерства охорони здоров'я Канади щодо останньої актуальної інформації для даного продукту.
Рекомендації Агентства Суспільної Охорони Здоров'я Канади також повинні братися до уваги.
Зміст
1.0 Форма випуску
2.0 Якісний і кількісний склад
- Спосіб застосування та дозування
- Протипоказання
- Попередження і заходи безпеки
- Взаємодія
- Вплив на здатність керувати автомобілем та механізмами
- Побічні реакції
- Клінічні випробування
- Передозування
4.0 Фармакологічні властивості
- Перелік допоміжних речовин
- Несумісність
- Термін придатності
- Особливі запобіжні заходи для зберігання
- Характер і вміст контейнерів
- Інструкції з використання / транспортування
- Інформація для споживача
Arepanrix™ H1N1 (вакцина від пандемічного грипу H1N1 з ад'ювантом AS03) є двокомпонентною вакциною, що складається з імунізуючого антигена H1N1 (у суспензії), і ад'юванта AS03 (у водо-олійній емульсії).
Антиген H1N1 – це стерильна суспензія, безбарвна або має легкий білуватий відтінок, яка може утворювати невеликий осад, розфасована у флакони 10 мл. Антиген виготовлено з вірусу, що було вирощено в аллантоїдній протоці ембріонів курячих яєць. Вірус деактивовано впливом ультрафіолету, потім формальдегідом, з подальшою очисткою центрифугуванням і розщепленням дезоксихолатом натрію.
Ад'ювантна система AS03 є стерильною, гомогенізованою білуватою емульсією, що складається з DL-?-токоферолу, сквалена та полісорбата-80 в 3 мл флаконі.
Безпосередньо перед застосуванням увесь вміст флакону AS03 потрібно додати до флакону з антигеном (пропорція 1:1). Отриманого в результаті готового препарату у вигляді емульсії достатньо для 10 доз.
2.0 Якісний і кількісний склад
Після з'єднання і змішування двох компонентів 0,5 мл отриманої емульсії набирають в шприц для внутрішньом'язових ін'єкцій. Остаточний склад компонентів вакцини у дозі 0,5 мл такий:
Антиген:
Розщеплений вірус грипу, інактивований, містить антиген* еквівалентний штаму A/California/7/2009 (H1N1)v (X-179A) - 3,75мкг HA** на дозу 0,5 мл:
* отримані з вірусу, вирощеного на курячих яйцях
** HA = гемаглютинін (haemagglutinin)
Вміст консерванту 5 мкг тимеросалу USP на дозу 0,5 мл або 2,5 мкг органічної ртуті (Hg) на дозу 0,5 мл.
Ад'ювант:
DL-?-токоферол - 11,86 мг на дозу 0.5 мл,
Сквален - 10,69 мг на дозу 0.5 мл,
Полісорбат 80 - 4,86 мг на дозу 0.5 мл.
Після змішування вмісту флаконів з суспензією та емульсією буде отримано багатодозову вакцину. Кількість доз у флаконі див. у розділі Форма і склад упаковки.
Для отримання повного списку допоміжних речовин, див. Список інгредієнтів в розділі 5.0.
Вакцина Arepanrix™ H1N1 призначена для активної імунізації проти штаму грипу H1N1 в умовах офіційно оголошеної пандемічної ситуації.
(див. розділ 2.0 Якісний і кількісний склад).
На даний момент досвід клінічних застосувань Arepanrix™ H1N1 є обмеженим, також є обмежений досвід клінічних застосувань експериментальної формули іншої вакцини з ад'ювантом AS03, яка містить таку ж або трохи більшу кількість антигену, отриманого з штаму A/California/7/2009 (H1N1) (див. розділ Фармакодинаміка), на здорових дорослих віком 18-60 років, і ще немає досвіду клінічних застосувань для старшої вікової групи, дітей та підлітків. Приймаючи рішення про використання Arepanrix™ H1N1 для кожної з визначених нижче вікових груп, слід брати до уваги наявний масив клінічних даних, доступних для версії вакцини з антигеном H5N1, та характеристики захворювання поточної пандемії грипу.
Рекомендації про дозування базуються на:
- доступних даних про безпечність та імуногенність введення вакцини з ад'ювантом AS03, яка містить 3,75 мкг НА, отриманого з вірусу A/Indonesia/5/2005 (H5N1) (Arepanrix™ H5N1), на 0 та 21 день у дорослих, включно з людьми похилого віку;
- доступних даних про безпечність та імуногенність введення дорослої та половини дорослої дози дітям від 3 до 9 років іншої вакцини з ад'ювантом AS03, яка містить 3,75мкг HA, отриманого з вірусу A/Vietnam/1194/2004 (H5N1), на 0 та 21 дні;
- обмежених даних про імуногенність з 2-х досліджень, отриманих через три тижні після введення однієї дози експериментального складу іншої вакцини H1N1 з ад'ювантом AS03, яка містить 5,25 мкг або 3,75 µg HA, отриманого з вірусу A/California/7/2009 (H1N1) (Pandemrix™), здоровим дорослим віком 18-60 років. Див. розділ Фармакодинаміка.
Дорослі віком 18-60 років:
Одна доза 0,5 мл у вибраний день.
Про потребу другої дози наразі невідомо. Проте, попередні дані про імуногенність, отримані через три тижні після введення експериментального складу іншої вакцини H1N1 з ад'ювантом AS03, яка містить 5,25 мкг або 3,75 мкг HA, отриманого з вірусу A/California/7/2009 (H1N1) (Pandemrix™), обмеженій кількості здорових дорослих віком 18-60 років, дозволяють припустити, що однієї дози може бути достатньо для цієї вікової групи. Див. розділ Фармакодинаміка.
Якщо є потреба в другій дозі, її слід вводити з інтервалом не менше 3 тижнів.
Літні люди (> 60 років):
Немає клінічних даних про застосування Arepanrix™ H1N1 для цієї вікової групи. Можна розглядати застосування 1 дози 0,5 мл у вибраний день.
Про потребу другої дози вакцини невідомо. Якщо є потреба в другій дозі, її слід вводити щонайменше з інтервалом 3 тижні. Див. розділ Фармакодинаміка.
Діти та підлітки віком 10-17 років:
Немає клінічних даних про застосування будь яких вакцин проти грипу з AS03 для цієї вікової групи. Можна розглядати застосування згідно дозування для дорослих.
Діти 3-9 років:
На основі обмежених клінічних даних про застосування вакцину H5N1 з ад'ювантом AS03, яка містить 3,75 мкг HA, отриманого з вірусу A/Vietnam/1194/2004, для цієї вікової групи - можна розглядати достатнім дозуванням 0,25 мл вакцини (половина дорослої дози) у вибраний день та друга доза щонайменше з інтервалом в 3 тижні. Див. розділ Фармакодинаміка.
Діти 6-35 місяців:
Немає клінічних даних про застосування вакцин проти грипу з AS03 для цієї вікової групи. Можна розглядати застосування згідно дозування для дітей 3-9 років.
Діти до 6 місяців:
Для цієї вікової групи вакцинацію на даний момент не рекомендовано.
Для отримання додаткової інформації див. розділ Фармакодинаміка.
Спосіб застосування:
Імунізацію слід робити внутрішньом'язовою ін'єкцією, бажано в дельтоподібний м'яз або в переднью бокову частину стегна (залежно від м'язової маси).
Історія анафілактичних (тобто загрозливих для життя) реакцій на будь-який з компонентів чи залишкових речовин цієї вакцини.
Див. також розділ Попередження і заходи безпеки.
З обережністю слід вводити вакцину людям з відомою гіперчутливістю (крім анафілактичних реакцій) до активної субстанції, будь-яких допоміжних речовин чи домішок.
Як і з усіма ін'єкційними вакцинами, потрібен відповідний медичний нагляд і наявність відповідних засобів на випадок рідкісних анафілактичних реакцій після введення вакцини.
Якщо пандемічна ситуація дозволяє, імунізацію особам з гострими інфекційними захворюваннями чи високою температурою слід відкласти.
За жодних умов не можна вводити Arepanrix™ H1N1 внутрішньовенно чи підшкірно.
Утворення антитіл у пацієнтів з ендогенними чи ятрогенними імуносупресіями може бути недостатнім.
Захисна імунна відповідь може створюватися не всіма вакцинами (див. розділ Фармакокінетика).
Діти:
Існує дуже обмежений досвід використання вакцини H5N1 з ад'ювантом AS03 для дітей від 3 до 9 років, і жодного досвіду для дітей до 3 років і підлітків 10-17 років. Див. розділи Дозування і застосування, Побічні реакції та Фармакодинаміка.
Вагітність і лактація
Немає даних про застосування вакцини Arepanrix™ H1N1 чи її прототипу (вакцини H5N1) з ад'ювантом AS03 для вагітних жінок. Дані про вакцинацію вагітних жінок тривалентними вакцинами проти сезонного грипу не вказують на те, що такі вакцини викликають шкідливі наслідки для ембріону або матері.
Слід брати до уваги усі рекомендації Агенції Охорони Громадського Здоров'я Канади.
Дослідження на тваринах не показали шкідливого впливу стосовно фертильності, вагітності, розвитку ембріону/плоду, пологів чи постнатального розвитку (див. також розділ Неклінічна інформація).
Немає даних про використання вакцини для жінок, що годують груддю.
Взаємодія
Немає даних про одночасне введення Arepanrix™ H1N1 з іншими вакцинами, включно з тривалентною вакциною проти сезонного грипу. Ці дані зараз збираються, і документ буде доповнено, як тільки вони будуть в наявності. Проте, якщо передбачено одночасне введення з іншою вакциною, їх слід вводити в різні кінцівки. Є повідомлення, що побічні реакції в таких випадках можуть бути сильнішими.
Імунна відповідь може бути ослабленою, якщо пацієнт приймає імуносупресивне лікування.
Після вакцинації проти грипу можуть бути отримані хибнопозитивні серологічні результати на антитіла до ВІЛ-1, гепатиту С та особливо HTLV-1 за методом ELISA. Ці тимчасові хибнопозитивні реакції можуть бути спричинені крос-реакцією IgM, спровокованою вакциною. З цієї причини достовірна діагностика ВІЛ-1, гепатиту C та HTLV-1 вимагає позитивного результату підтверджувального тесту для конкретного вірусу (наприклад Western Blot або immunoblot).
Вплив на здатність керувати автомобілем та механізмами
Не проводилося досліджень впливу на можливість керування автомобілем та механізмами.
Дослідження H1N1:
Попередні дані про реактогенність (очікувані місцеві та загальні побічні реакції, повідомлені впродовж 7 днів після вакцинації) отримано з 2-х досліджень безпечності, проведених для іншої вакцини з ад'ювантом AS03, яка містить HA з вірусу типу A/California/7/2009 (H1N1)v (Pandemrix™) на здорових піддослідних віком 18-60 років. В іншому дослідженні вакцина містить більшу кількість антигену (5,25 мкг HA). В обох дослідженнях група піддослідних отримувала вакцину без ад'юванта AS03. Про наявні очікувані місцеві та загальні симптоми частіше повідомлялося в групі H1N1+AS03, ніж у групі H1N1. Серед побічних реакцій (АЕ), про які повідомлялося найчастіше, - біль у місці введення. Частота симптомів, що "характеризувалися" Рівнем 3, не перевищувала 1,6%.
Таблиця H1N1-021 (0 - 6 день, очікувані побічні реакції після 1 дози вакцини H1N1, що містить 5,25 мкг HA + AS03 [Pandemrix™] в порівнянні з однією дозою вакцини H1N1, що містить 21 мкг HA без ад'юванту) - побічні дії з причинно-наслідковим зв'язком.
|
Побічні реакції |
H1N1/AS03 |
H1N1 |
|
Біль |
88,9% |
59,1% |
|
Почервоніння |
31,7% |
4,5% |
|
Набряк |
30,2% |
1,5% |
|
Втома |
15,9% |
10,6% |
|
Головний біль |
14,3% |
7,6% |
|
Артралгії |
14,3% |
3,0% |
|
Міальгії |
15,9% |
4,5% |
|
Озноб |
3,2% |
4,5% |
|
Потовиділення |
6,3% |
4,5% |
|
Лихоманка |
0,0% |
0,0% |
Таблиця H1N1-007 (0 - 6 день, очікувані побічні реакції після 1 дози вакцини H1N1, що містить 3,75 мкг HA + AS03 [Pandemrix™] проти одної дози вакцини H1N1, що містить 15 мкг HA без ад'юванта) - побічні дії з причинним зв'язком.
|
Побічні реакції |
H1N1/AS03 |
H1N1 |
|
Біль |
90,3% |
37,1% |
|
Почервоніння |
1,6% |
0,0% |
|
Набряк |
6,5% |
0,0% |
|
Втома |
32,3% |
25,8% |
|
Головний біль |
14,3% |
7,6% |
|
Артралгії |
11,3% |
4,8% |
|
Міальгії |
33,9% |
8,1% |
|
Озноб |
8,1% |
3,2% |
|
Потовиділення |
9,7% |
8,1% |
|
Лихоманка |
0,0% |
0,0% |
Загалом було повідомлено про 4 випадки серйозних побічних реакцій (SAE) під час досліджень H1N1. Три з них дослідники не пов'язують з досліджуваною вакциною. Один випадок гіперчутливості пов'язують з вакциною.
Дослідження H5N1:
Клінічні випробування
Побічні дії, виявлені під час клінічних випробувань експериментальної вакцини, наведені нижче:
Дорослі:
Під час клінічних випробувань оцінено відсоток побічних реакцій серед приблизно 3500 піддослідних, починаючи з 18-річного віку, які отримали протигрипову вакцину, що містить штам A/Indonesia/05/2005 (Arepanrix™ H5N1) з щонайменше 3,75 мкг HA/AS03.
Реактогенність вакцинації отримана за результатами збору побічних реакцій за допомогою стандартизованих форм впродовж 7 днів, наступних після вакцинації з Arepanrix™ H5N1 або плацебо (тобто День 0 - День 6). Середню частоту отриманих місцевих і загальних побічних реакцій, повідомлених впродовж 7 днів після кожної дози вакцини, наведено нижче:
Відсоток доз, після введення яких повідомлено про місцеві або загальні реакції протягом 7 днів після будь-якої вакцинації Arepanrix™ H5N1 (Загальний вакцинований контингент*)
|
Місцеві |
AREPANRIX ™ H5N1 |
Плацебо |
|
N = 6647 доз |
N = 2209 доз | |
|
Біль |
73,1 |
12,0 |
|
Набряк |
6,7 |
0,4 |
|
Почервоніння |
5,25 |
0,4 |
|
Загальні |
N = 6639 доз |
N = 2210 доз |
|
Біль у м'язах |
33,3 |
11,8 |
|
Головний біль |
23,4 |
17,6 |
|
Втома |
23,3 |
14,1 |
|
Біль у суглобах |
16,4 |
7,4 |
|
Озноб |
9,8 |
6,0 |
|
Потовиділення |
6,3 |
4,4 |
|
Лихоманка, ? 38,0 °C |
2,4 |
1,9 |
* Загальний вакцинований контингент = усі суб'єкти, які отримали принаймні одну дозу вакцини, і щодо яких наявні дані про безпечність.
З очікуваних місцевих реакцій найчастіше повідомляється про біль в місці ін'єкції в обидвох групах: Arepanrix™ H5N1 і плацебо. В групі Arepanrix™ H5N1 про цю реакцію повідомлялося в 6 разів частіше (73% доз). Не зважаючи на високий відсоток повідомлень про біль у місці ін'єкції, відсоток реакцій з сильним болем є низький, про нього повідомляють після 2,7% доз Arepanrix™ H5N1 і 0,4% доз плацебо. Загалом, важкі очікувані і неочікувані побічні реакції будь-якого типу виникали впродовж 7 днів після введення від 6,4 до 7,0% доз Arepanrix™ H5N1 і 3,6% доз плацебо. Найпоширенішими важкими побічними реакціями був локальний біль у місці ін'єкції, всі важкі загальні очікувані реакції виникали після менш, ніж 2% доз.
Інші/додаткові повідомлені побічні реакції, наведені згідно частотної класифікації:
- дуже часті (понад 1/10),
- часті (від 1/100 до 1/10),
- нечасті (від 1/1000 до 1/100),
- рідкісні (від 1/10000 до 1/1000),
- дуже рідкісні (рідше 1/10000),
- невідомо (неможливо визначити з наявних даних).
Розлади кровоносної та лімфатичної систем
Часті: лімфаденопатія
Психічні розлади
Нечасті: безсоння
Розлади нервової системи
Нечасті: запаморочення, парестезія
Розлади зі сторони органу слуху та рівноваги
Нечасті: головокружіння
Розлади зі сторони органів дихання, грудної клітини та середостіння
Нечасті: задишка
Шлунково-кишкові розлади
Часті: нудота, діарея
Нечасті: біль у животі, рвота, розлад травлення, дискомфорт в шлунку
Розлади шкіри та підшкірних тканин
Часті: свербіж
Нечасті: висипка
Розлади м'язово-скелетних та сполучних тканин
Нечасті: біль у спині, скелетно-м'язова скутість, біль у шиї, м'язові спазми, біль у кінцівках
Загальні розлади і стан місця ін'єкції
Часті: реакції в місці ін'єкції (гематоми, свербіж, гарячість)
Нечасті: слабкість, біль у грудях, погане самопочуття
Серйозні побічні реакції у дорослих
Загальний звіт про безпечність було розроблено на основі даних перших 9873 дорослих, які отримали ін'єкції Arepanrix™ H5N1 або дуже подібного препарату Pandemrix™ H5N1 з антигеном грипу, виготовленого в Німеччині з додаванням ад'юванта AS03. До цих досліджень було залучено дорослих віком від 18 років та старших з попередніми хронічними захворюваннями. В початковому аналізі, під час якого було порівняно 6-місячне спостереження за безпечністю після введення 7224 реципієнтам препарату Arepanrix™ H5N1 або Pandemrix™ H5N1 і таке ж спостереження за 2408 реципієнтами вакцини від сезонного грипу або плацебо, серйозні побічні реакції виникли у 1,6% реципієнтів Arepanrix™ H5N1 або Pandemrix™ H5N1 (95% довірчий інтервал 1,3 - 1,9%) проти 1,3% реципієнтів вакцини від сезонного грипу (95% довірчий інтервал 0,7 - 2,0%) та 1,8% у реципієнтів плацебо (95% довірчий інтервал 1,1 - 2,8%). Дослідники не пов'язують жодну з серйозних реакцій з досліджуваним препаратом. Серед реципієнтів Arepanrix™ H5N1 або Pandemix™ H5N1 п’ятеро (<0,1%) отримали фатальні серйозні побічні реакції, в тому числі два випадки карциноми яєчників, злоякісне метастазне утворення невизначеного типу, інфаркт міокарда, та загострення цукрового діабету і цироз печінки. Серед реципієнтів плацебо троє (0,1%) отримали фатальні серйозні побічні реакції, один випадок пухлини мозку, один випадок кардіомегалії після хронічного обструктивного легеневого захворювання, і один випадок двосторонньої пневмонії. Впродовж 6 місяців спостереження за загальною групою 9873 реципієнтів Arepanrix™ або Pandemrix™ H5N1 7 (<0,1%) повідомили про побічну реакцію з переліку тих, що заслуговують на ретельне дослідження, визначене EMEA. Четверо осіб повідомили про параліч лицьового нерва (параліч Бела) в період від кількох годин до 135 днів після введення вакцини, всі прояви зникли повністю і без втручання. 45-річний чоловік мав анафілактичну алергічну реакцію на їжу через 6 днів після першого введення вакцини H5N/AS03, а 25-річна біла жінка мала один напад судом через 35 днів після введення другої дози. Дослідники не пов'язують жодної з цих реакцій з переліку тих, що заслуговують ретельного дослідження, з введеним препаратом. Одна 48-річна жінка мала напад "невриту" майже одразу після ін'єкції. Симптоми були повністю локалізовані в тій руці, в яку робили ін'єкцію, і зникли без втручання. Одинадцять з 9873 (0,1%) реципієнтів Arepanrix™ або Pandemrix™ H5N1 повідомили про можливі імуно-обумовлені захворювання. Діагнози включали два випадки псоріазу, чотири випадки ревматичної поліміалгії (всі у жінок від 59 до 84 років, у трьох з них симптоми спостерігалися і до вакцинації) і по одному випадку дифузно-токсичного зобу, увеїту, склеродермії, ізольований паралічу IV нерва (?) і вузлової еритеми. Жодний з цих випадків дослідники не віднесли до серйозних побічних реакцій або таких реакцій, що пов'язані з досліджуваною вакциною.
Діти у віці 3-9 років:
Під час клінічних досліджень оцінено реактогенність у дітей вікових груп від 3 до 5 і від 6 до 9 років, які отримували повну або половинну дозу вакцини з ад'ювантом AS03, яка містила 3,75 мкг HA, отриманого з вірусу A/Vietnam/1194/2004 (H5N1).
Частота реакцій на одну дозу у дітей, що отримували повну дозу вакцини з ад'ювантом AS03, яка містила 3,75 мкг HA, отриманого з вірусу A/Vietnam/1194/2004 (H5N1), була вищою, аніж у груп дітей, які отримували половинну дозу, окрім реакції почервоніння у групи 6-9 років. Частота специфічних очікуваних побічних реакцій через 7 днів після кожної дози подана в таблиці. Реакції рівня 3 (важкі) усіх типів, очікувані та неочікувані, впродовж 7 днів спостерігалися після 9,3% доз Arepanrix™ H5N1 і після 2,8% контрольних доз вакцини Fluarix™.
Реактогенність у дітей вікових груп від 3 до 5 і від 6 до 9 років (повна або половинна дозу вакцини з ад'ювантом AS03, яка містила 3,75 мкг HA, отриманого з A/Vietnam/1194/2004 (H5N1) в порівнянні з Fluarix™) - реакції з причинним зв'язком.
|
Побічні реакції |
3-5 років |
6-9 років | ||||||
|
Половинна доза |
Fluarix |
Повна доза |
Fluarix |
Половинна доза |
Fluarix |
Повна доза |
Fluarix | |
|
Ущільнення |
9,9% |
2,9% |
18,6% |
0% |
12,0% |
22,2% |
12,2% |
2,8% |
|
Біль |
48,5% |
28,6% |
62,9% |
23,5% |
68,0% |
58,3% |
73,5% |
61,1% |
|
Почервоніння |
10,9% |
5,7% |
19,6% |
8,8% |
13,0% |
16,7% |
6,1% |
2,8% |
|
Набряк |
11,9% |
2,9% |
24,7% |
5,9% |
14,0% |
19,4% |
20,4% |
8,3% |
|
Лихоманка (> 38 ° C) |
2,0% |
0% |
6,2% |
0% |
2,0% |
2,8% |
10,2% |
0% |
|
Лихоманка (> 39 °C) на дозу, частота |
2,0% |
0% |
5,2% |
0% |
0% |
2,8% |
7,1% |
0% |
|
Лихоманка (> 39 ° C) на реципієнта, частота |
3,9% |
0% |
10,2% |
0% |
0% |
5,6% |
14,3% |
0% |
|
Сонливість |
7,9% |
2,9% |
13,4% |
2,9% |
NA |
NA |
NA |
NA |
|
Дратівливість |
7,9% |
2,9% |
18,6% |
0% |
NA |
NA |
NA |
NA |
|
Втрата апетиту |
6,9% |
2,9% |
16,5% |
2,9% |
NA |
NA |
NA |
NA |
|
Озноб |
1,0% |
0% |
12,4% |
2,9% |
4,0% |
5,6% |
14,3% |
11,1% |
NA = Немає даних
Серйозні реакції (SAE) у дітей
В аналізованій клінічній базі даних, що охоплює 180-денне спостереження, серед дітей віком 3-9 років, які отримали половинну дозу вакцини A/Vietnam/1194/04/AS03, серйозних реакцій не було зафіксовано. Серед дітей, які отримали повну дозу вакцини, один 5-річний хлопчик госпіталізований з гастроентеритом через 19 днів після другої дози, і 4-річна дівчинка отримала травматичне ушкодження мозку через 54 дні після другої дози. Жоден з цих випадків не пов'язують з вакцинацією, обоє дітей одужали. Одна 3-річна дівчинка, яка брала участь у випробування вакцини H5N1/AS03, що містила інший відсоток ад'юванта, ніж Arepanrix™ H1N1, отримала діагноз автоімунного гепатиту приблизно через 1 рік після введення однієї дози вакцини. Згодом виявлено, що у дитини вже були суттєві порушення сироваткової трансамінази (serum transaminases) ще до введення будь-якої вакцини. Одна 5-річна дівчинка отримала діагноз передній увеїт через 8 днів після другої повної дози Pandemrix™ H5N1. Реакцію розглядають як можливо пов'язану з вакциною, однак також таку, що виникла в умовах наявного набору інфекційних симптомів тонзиліту та гінгвостоматиту.
Пост-маркетингове спостереження
Під час постмаркетингового спостереження за застосуванням сезонної тривалентної вакцини (без AS03) повідомлено про такі додаткові побічні реакції:
Розлади кровоносної та лімфатичної систем
Транзитна тромбоцитопенія (Transient thrombocytopenia).
Розлади імунної системи
Алергічні реакції, які в окремих випадках призводили до шоку.
Розлади нервової системи
Невралгія, судоми.
Неврологічні розлади, зокрема енцефаломієліти, неврити та синдром Гійена-Барре.
Судинні розлади
Васкуліти з минущим ураження нирок.
Розлади шкіри та підшкірних тканин
Генералізовані шкірні реакції, включно з кропивницею
Передозування
Брак даних
4.0 Фармакологічні властивості
Фармакологічна група: Вакцини від грипу, ATC код J07BB02.
Дослідження H1N1:
МОЗ Канади регулярно переглядатиме нову інформацію, і цей листок буде оновлюватися. Про пандемічний штам H1N1 наразі відомо наступне.
Імунна відповідь на експериментальну формулу іншої вакцини з ад'ювантом AS03, яка містить 5,25 мкг HA, отриманого з A/California/7/2009 (H1N1) (Pandemrix™) у дорослих 18-60 років
У клінічних дослідженнях, що оцінювали імуногенність іншої вакцини з ад'ювантом AS03, яка містить 5,25 мкг HA, отриманого з v-подібного антигену A/California/7/2009 (H1N1), у здорових осіб віком 18-60 років утворення антитіл anti-HA після 1 дози розподілилося наступним чином:
|
anti-HA антитіла |
Імунна відповідь на v-антиген A/California/7/2009 (H1N1) 21 день після першої дози | |
|
Вакцина H1N1 без ад'юванта |
Вакцина H1N1 з ад'ювантом AS03 | |
|
Рівень серозахисту 1 |
97,0 % |
98,4% |
|
Рівень сероконверсії 2 |
95,5 % |
98,4% |
|
Фактор сероконверсії 3 |
41,4 |
41,4 |
1 Рівень серозахисту: пропорція осіб з титром пригнічення гемаглютиніну (HI) ?1:40;
2 Рівень сероконверсії: пропорція осіб, що були серонегативними до і мають захисний титр ?1:40 після вакцинації, або ж були серопозитивними до вакцинації і отримали 4-разове зростання титру;
3 Фактор сероконверсії: співвідношення середньо-геометричного титру (GMT) після вакцинації і до неї.
Імунна відповідь на експериментальну формулу іншої вакцини з ад'ювантом AS03, яка містить 3,75 мкг HA, отриманого з A/California/7/2009 (H1N1) (Pandemrix™) у дорослих 18-60 років
У клінічних дослідженнях, які оцінювали імуногенність іншої вакцини з ад'ювантом AS03, яка містить 3,75 мкг HA, отриманого з v-подібного антигену A/California/7/2009 (H1N1), у здорових осіб віком 18-60 років утворення антитіл anti-HA після 1 дози розподілилося наступним чином:
|
anti-HA антитіла |
Імунна відповідь на v-антиген A/California/7/2009 (H1N1) через 21 день після першої дози | |
|
Вакцина H1N1 без ад'юванта |
Вакцина H1N1 з ад'ювантом AS03 | |
|
Рівень серозахисту 1 |
93,9% |
100% |
|
Рівень сероконверсії 2 |
84,8% |
96,7% |
|
Фактор сероконверсії 3 |
31,0 |
43,3 |
1 Рівень серозахисту: пропорція осіб з титром пригнічення гемаглютиніну (HI) ?1:40;
2 Рівень сероконверсії: пропорція осіб, що були серонегативними до і мають захисний титр ?1:40 після вакцинації, або ж були серопозитивними до вакцинації і отримали 4-разове зростання титру;
3 Фактор сероконверсії: співвідношення середньо-геометричного титру (GMT) після вакцинації і до неї.
Дослідження H5N1:
Попередні дані, отримані для пандемічних вакцин H1N1, дають припущення, що імуногенність вакцин H1N1 суттєво відрізняється від імуногенності вакцин H5N1. Цей розділ описує клінічні дані, отримані для експериментальних вакцин, зібрані під час клінічних випробувань H5N1, іншого штаму з пандемічним потенціалом.
Імунна відповідь на A/Indonesia/5/2005 (H5N1) у дорослих (від 18 років):
Під час клінічних випробувань оцінено імуногенність вакцини з ад'ювантом AS03, яка містить 3,75 мкг HA, отриманого з A/Indonesia/5/2005, в осіб віком від 18 років згідно з графіком 0, 21 день.
В наступному дослідженні утворення антитіл антигемаглютиніну (anti-HA) на 21 день і через 6 місяців після введення 2-ї дози було таким:
|
anti-HA антитіла |
Імунна відповідь до A/Indonesia/5/2005 | |||
|
18-60 років |
> 60 років | |||
|
День 42 |
День 180 |
День 42 |
День 180 | |
|
Рівень серозахисту 1 |
91% |
62% |
76,8% |
63,5% |
|
Рівень сероконверсії 2 |
91% |
62% |
76,4% |
62,5% |
|
Фактор сероконверсії 3 |
51,4 |
7,4 |
17,2 |
7,8 |
1 Рівень серозахисту: пропорція осіб з титром пригнічення гемаглютиніну (HI) ?1:40;
2 Рівень сероконверсії: пропорція осіб, що були серонегативними до і мають захисний титр ?1:40 після вакцинації, або ж були серопозитивними до вакцинації і отримали 4-разове зростання титру;
3 Фактор сероконверсії: співвідношення середньо-геометричного титру (GMT) після вакцинації і до неї.
Через 21 день після другої дози чотириразове зростання нейтралізуючих антитіл до A/Indonesia/5/2005 було досягнуто у 94,4% осіб віком 18-60 років і 80,4% осіб віком понад 60 років.
Імунна відповідь на A/Vietnam/1194/2004 (H5N1) у дітей (3 - 9 років)
Під час клінічного дослідження було оцінено імуногенність і безпечність у дітей вікових груп від 3 до 9 років. У цьому дослідженні 49 дітей віком від 3 до 5 років і 49 дітей віком від 6 до 9 років отримали дві дози іншої вакцини з вмістом AS03 і 3,75 мкг HA штаму A/Vietnam/1194/2004 (H5N1) в 0 і 21 день.
Рівень серо-захисту, показник конверсії сироватки і фактор конверсії сироватки для anti-HA в цих осіб був таким:
|
anti-HA антитіла |
A/Vietnam/1194/2004 | |||
|
Діти від 3 до 5 років |
Діти від 6 до 9 років | |||
|
21 день після |
21 день після |
21 день після |
21 день після | |
|
Рівень серозахисту (*) 1 |
46,5% |
100% |
56,7% |
100% |
|
Рівень сероконверсії 2 |
46,5% |
100% |
56,7% |
100% |
|
Фактор сероконверсії 3 |
5,0 |
191,3 |
5,5 |
176,7 |
* anti-HA ?1:40
1 Рівень серозахисту: пропорція осіб з титром пригнічення гемаглютиніну (HI) ?1:40;
2 Рівень сероконверсії: пропорція осіб, що були серонегативними до і мають захисний титр ?1:40 після вакцинації, або ж були серопозитивними до вакцинації і отримали 4-разове зростання титру;
3 Фактор сероконверсії: співвідношення середньо-геометричного титру (GMT) після вакцинації і до неї.
4-разове зростання у сироватці титру нейтралізуючих антитіл спостерігалося у 97,4% осіб віком 3-5 років та у 100% осіб віком 6-9 років через 21 день після введення 2-ї дози.
Також було оцінено стійкість імуногенності у цих дітей через 6 місяців. Рівень серо-захисту, показник конверсії сироватки і фактор конверсії сироватки для anti-HA на 180 день становив відповідно 82,8%, 82,8% та 16 у дітей 3-5 років та 78%, 78% і 12,3 у дітей 6-9 років.
Інформація з неклінічних досліджень
Здатність викликати захист проти гомологічних вакцинних штамів була визначена в неклінічних умовах відносно A/Indonesia/05/05 (H5N1) з застосуванням моделі випробування на тхорах.
- Випробування з використянням гомологічного пандемічного H5N1 штаму (A/Indonesia/5/05)
В цьому експерименті щодо захисних властивостей, тхорів (шість груп) було внутрішньом’язово імунізовано випробуваними версіями вакцин, що містили три різні дози антигену H5N1 (7,5, 3,8 та 1,9 мкг HA антигену) разом з стандартною або половинною дозою ад’юванту AS03. Контрольні групи включали в себе тхорів імунізованих одним лише ад’ювантом та самою вакциною без ад’юванту (7,5 µg HA). Тхори, імунізовані без-ад’ювантною вакциною проти грипу H5N1 виявилися незахищеними і загинули, виявивши подібну картину зменшеного вірусного навантаження в легенях та часткове вірусне ураження верхніх дихальних шляхів, що було виявлено й у тварин, імунізованих самим лише ад’ювантом. З іншого боку, комбінації різних доз антигену H5N1 з ад’ювантом AS03 виявили здатність захищати від смерті, зменшувати вірусне навантаження в легенях та впливати на розповсюдження вірусу після внутрішньо-трахеального введення гомологічного дикого типу вірусу H5N1. Серологічні дослідження показали пряму кореляцію між гальмуванням гемаглютинації під дією вакцин та нейтралізуючими титрами антитіл у захищених тварин порівняно з контрольними групами, яким було введено лише антиген чи ад’ювант.
Вакцини, використані у фармакологічних дослідженнях
Pandemrix™ - вакцина H1N1 з ад'ювантом AS03, що містить 5,25 мкг або 3,75 мкг HA, отриманого з A/California/7/2009 (H1N1), виготовлена у м. Дрезден, Німеччина, за іншою технологією, ніж Arepanrix™ H1N1 (A/California/7/2009).
Інша вакцина H5N1 з ад'ювантом AS03 містить 3,75 мкг HA, отриманого з A/Vietnam/1194/2004 (H5N1; раніше була відома під назвою Pandemrix™ H5N1) також виготовлена у м. Дрезден, Німеччина, за тією ж технологією, що і Pandemrix™ (зі штамом H1N1).
Arepanrix™ H5N1 - вакцина H5N1 з ад'ювантом AS03, що містить 3,75 мкг HA, отриманого з A/Indonesia/5/2005 (H5N1), виготовлена у м. Квебек, Канада за тією ж технологією, що і пандемічна вакцина Arepanrix™ H1N1 (A/California).
Фармакокінетика
Оцінка фармакокінетичних властивостей не є обов'язковою для вакцин.
Доклінічні дані про безпечність
Неклінічні дані не показали специфічної шкоди для людей на основі традиційних досліджень безпечності фарм. препаратів, токсичності однієї та повторюваних доз, місцевої реакції, жіночої репродуктивності, токсичності для ембріона/плоду і постнатальної токсичності до завершення лактаційного періоду.
Два дослідження щодо репродуктивності проводилися з антигеном H5N1 з ад'ювантом і оцінили вплив на ембріон/плід, перинатальний та постнатальний розвиток у щурів після внутришньом'язового введення. Хоч і не можна зробити жодних остаточних висновків щодо можливого зв'язку з вакциною H5N1 та/або ад'ювантом AS03, й інші дані є нормальними, такі результати заслуговують на увагу: у першому дослідженні спостерігалося збільшення випадків вад ембріонів з виразним середнім потовщенням/вигинанням ребер та деформацією лопаток, а також збільшення випадків розширення мочетоків та затримок невро-поведінкового розвитку. У другому дослідженні спостерігалося збільшення випадків викиднів після імплантації плідного яйця, а також потовщення мочетоків у плоду. В обох дослідженнях не було опрацьовано всіх даних, тому суттєвість токсикологічного впливу залишилась невизначеною.
Перелік допоміжних речовин
Антиген, суспензія у флаконі: тімеросал, хлорид натрію, фосфат динатрію водню, фосфат калію дигідрофосфат, калію хлорид, вода для ін'єкцій. Речовина препарату містить залишкові сліди яєчного білка, формальдегіду, дезоксіхолата натрію та цукрози.
Ад'ювант, емульсія у флаконі: хлорид натрію, фосфат динатрію водню, фосфат калію дигідрофосфат, калію хлорид, вода для ін'єкцій.
Несумісність
За відсутності достатніх досліджень цей препарат не слід використовувати одночасно з іншими лікарськими засобами.
Термін придатності
Суспензія антигену є стабільною впродовж 18 місяців.
Емульсія ад'юванту є стабільною 3 роки.
Після змішування вакцину потрібно використати впродовж 24 годин. Рекомендовано зберігати змішаний препарат при температурі 2°- 8°C, однак за потреби можна зберігати його і при кімнатній температурі. У разі охолодження препарат потрібно довести до кімнатної температури перед введенням. Хімічна і фізична стабільність для використання була продемонстрована впродовж 24 годин при температурі 30°C.
Особливі запобіжні заходи для зберігання
Зберігати при температурі +2 ° С до +8 ° С (в холодильнику).
Не заморожувати.
Зберігати в оригінальній упаковці з метою захисту від світла.
Характер і вміст контейнерів
Одна упаковка містить:
- 1 упаковка з 50 флаконів (скло, тип 1) по 2,5 мл суспензії (10 доз по 0,25 мл) з пробкою (бутилкаучук без латексу);
- 2 упаковки з 25 флаконів (скло, тип 1) по 2,5 мл емульсії (10 доз по 0,25 мл) з пробкою (бутилкаучук без латексу).
Об'єм, отриманий після змішування 1 флакону суспензії та 1 флакону емульсії, дозволяє ввести 10 доз по 0,5 мл вакцини (5 мл).
Інструкції з використання / застосування
Arepanrix™ H1N1 складається з двох контейнерів: один мультидозовий флакон, що містить антиген (суспензія) та другий мультидозовий флакон з ад’ювантом (емульсія). Суспензія з антигеном має колір від напівпрозорого до білувато-молочного і може містити невеликий осад. Емульсія – білувата однорідна рідина.
Для використання ці два компоненти повинні бути змішаними. Весь вміст ад'ювантної емульсії потрібно перемістити до флакону за антигеном та перемішати.
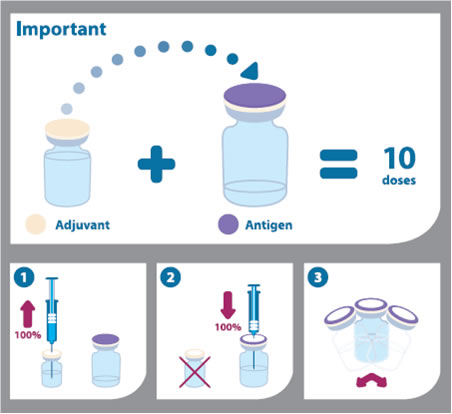
Інструкція для змішування та введення вакцини (як зображено на піктограмі нижче):
- Перед змішуванням двох компонентів флакони повинні бути доведені до кімнатної температури, а також треба струсити емульсію та суспензію і візуально оглянути на предмет наявності будь-яких вад.
- Вакцину змішують шляхом витягання всього вмісту флакона з емульсією за допомогою шприца і додавання його у флакон, що містить суспензію антигену.
- Після додавання емульсії до суспензії, суміш повинна бути добре струшена. Змішана вакцина є білуватою емульсією. У випадку іншого вигляду чи змін у суміші, вона не повинна використовуватися.
- Цей змішаний об'єм Arepanrix™ H1N1 (5 мл) включає в себе 10 доз вакцини.
- Флакон повинен струшуватися перед кожним використанням.
- Кожна доза вакцини 0,5 мл набирається в шприц для ін'єкцій. Перед використанням вакцина повинна бути доведена до кімнатної температури.
- Голка, що використовувалася для набирання дози з флакона, повинна бути замінена на голку для внутрішньом'язових ін'єкцій.
Будь-який невикористаний продукт або відходи повинні вилучатися відповідно до місцевих вимог.

Arepanrix™ H1N1 є торговою маркою групи компаній GlaxoSmithKline.
AREPANRIX™ H1N1
Вакцина проти пандемічного H1N1 грипу з ад'ювантом AS03.
Цей текст є частиною "Комплектації пакунку" і призначений спеціально для споживачів. Він являє собою резюме і не містить всіх подробиць про AREPANRIX™ H1N1. Зверніться до свого лікаря або фармацевта, якщо у вас є які-небудь питання щодо вакцини.
МОЗ Канади дозволило продаж Arepanrix™ H1N1 на основі обмежених клінічних випробувань на людях у відповідності до положень Тимчасового Порядку, опублікованого 13 жовтня 2009 року. Дозвіл базується на вивченні Міністерством охорони здоров'я Канади наявної інформації про її якість, безпечність та імуногенність. З огляду на поточну загрозу пандемії та її ризик для здоров'я людей, МОЗ Канади вважає співвідношення переваг і ризиків від використання вакцини Arepanrix™ H1N1 прийнятним для активної імунізації проти штаму грипу H1N1 2009 в умовах офіційно оголошеної пандемічної ситуації.
У рамках дозволу на продаж Arepanrix™ H1N1 МОЗ Канади вимагає від ініціаторів постмаркетингових зобов'язань. Виконання цих зобов'язань та оновлення інформації про якість, неклінічних та клінічних даних постійно моніторитиметься Міністерством охорони здоров'я Канади та Агентством суспільної охорони здоров'я Канади.
Про цю вакцину
Призначення вакцини: AREPANRIX™ H1N1 є вакциною для захисту від грипу, що викликається вірусом H1N1.
Дія:
Після введення вакцини в організм імунна система (природна система захисту організму) вироблятиме антитіла проти вірусу H1N1. Очікується, що ці антитіла захищатимуть від захворювання, спричиненого вірусом. Жоден з інградієнтів вакцини не може викликати грип. Вакцина не містить живого вірусу.
Як і будь-яка інша вакцина, AREPANRIX™ H1N1 не може повністю захистити всіх людей, що були вакциновані.
Коли вона не повинна використовуватися:
Не використовуйте цю вакцину, якщо у вас вже спостерігалися алергічні реакції з загрозою життю на:
- яєчний білок (яйця чи страви з них) або курячий білок;
- інші вакцинації проти грипу;
- будь-який компонент цієї вакцини.
Ознаки алергічної реакції можуть включати висипку, свербіння шкіри, задишку і набряк обличчя та язика.
Медичні інгредієнти:
Антиген грипу H1N1 зі штаму A/California/7/2009 NYMC X-179A (H1N1)v та ад'ювант AS03
Важливі немедичні інградієнти:
Тімеросал, похідна ртуті, додається як консервант. Кожна доза містить 2,5 мкг ртуті.
Інші інгредієнти включають: сквален, вітамін Е, полісорбат 80, залишкові сліди яєчного білка, формальдегіду, дезоксіхолату натрію та цукрози.
Повний перелік немедичних інгредієнтів див. в першій частині документу (розділ 5.0).
Виробляється у формі:
AREPANRIX ™ H1N1 - це дво-компонентна вакцина, що складаються з суспензії антигену, яка має колір від напівпрозорого до білувато-молочного та може утворювати легкий осад, та білуватої емульсії, що містить ад'ювант AS03. Вакцина AREPANRIX™ H1N1 - це емульсія для ін'єкцій.
Попередження і заходи безпеки
Серйозні Попередження і заходи безпеки
Негайно зверніться до лікаря чи медсестри, якщо невдовзі після введення виникли такі реакції:
- висипка на тілі,
- скутість у горлі,
- задишка.
ПЕРШ НІЖ використовувати AREPANRIX™ H1N1, повідомте Вашого лікаря або медичну сестру, якщо:
- у вас важке інфекційне захворювання з високою температурою,
- у вас ослаблена імунна система через лікування чи захворювання, наприклад ВІЛ.
Взаємодія з іншими вакцинами
Наразі немає інформації про використання AREPANRIX™ H1N1 разом з іншими вакцинами.
Належне використання цієї вакцини
Звичайна доза:
Одна ін'єкція. Може бути введено другу дозу. Другу дозу слід вводити щонайменше з інтервалом 3 тижні після першої.
- Діти (>9 років) та дорослі: 0,5 мл/доза,
- Діти 3-9 років: 0,25 мл/доза,
- Діти 6-35 місяців 0,25 мл/доза (Немає клінічних даних про застосування вакцин проти грипу з ад'ювантом AS03 для цієї вікової групи).
Інформація про цей продукт буде регулярно оновлюватись. Слідкуйте за сайтом Міністерства охорони здоров'я Канади для отримання актуальної інформації про цей продукт.
Побічні ефекти та реакція на них
Як і всі лікарські засоби, AREPANRIX™ H1N1 може викликати побічні наслідки. Найпоширеніші та часті побічні реакції є зазвичай несильними і повинні тривати не більше 1-2 днів.
Найпоширеніші (можуть виникати у більш ніж 1/10 вакцинованих):
- Біль у місці ін'єкції
- Головний біль
- Втома
- Почервоніння чи набряк у місці ін'єкції
- Озноб
- Потовиділення
- Біль в м'язах чи у суглобах
Часті (можуть виникати у менш ніж 1 з 10 вакцинованих):
- Реакції в місці ін'єкції, такі як гематоми, свербіж та гарячість
- Лихоманка
- Набряк лімфатичних вузлів
- Нудота, діарея
Нечасті (можуть виникати менш ніж 1 зі 100 доз):
- Запаморочення
- Загальне погане самопочуття
- Незвичайна слабкість
- Блювота, біль у шлунку, дискомфорт у шлунку, відрижка після їжі
- Порушення сну
- Поколювання або оніміння кінцівок рук або ніг
- Задишка
- Біль у грудях
- Свербіж шкіри, висипка
- Біль у спині чи шиї, скутість м'язів, спазми м'язів, біль у кінцівках рук чи ніг.
Поодинокі (можуть відбутися до 1 на 1000 доз):
- Алергічні реакції, що можуть спричинити серйозні підвищення кров'яного тиску, який, якщо не вжити заходів, може спричинити шок. Лікарі знають про таку можливість і мають засоби для невідкладної допомоги у цьому випадку.
- Судоми.
- Сильний пронизливий або пульсуючий біль вздовж одного або декількох нервів.
- Низька кількість тромбоцитів, що може призводити до кровотечі чи гематоми.
Дуже рідкісні (можуть відбутися до 1 на 10000 доз):
- Васкуліт (запалення кровоносних судин, яке може викликати висипи на шкірі, біль в суглобах і проблеми з нирками).
- Неврологічні розлади, такі як енцефаломієліт (запалення центральної нервової системи), неврити (запалення нервів) і тип паралічу, відомий як синдром Гійена-Барре.
У разі виникнення будь-якої з цих реакцій негайно повідомте лікаря чи медсестру. Якщо будь-яка з цих реакцій отримує серйозний перебіг, чи виникла якась реакція поза наведеним переліком, будь-ласка, повідомте про це лікаря.
Зберігання
Зберігати в холодильнику (2 ° С до +8 ° С) в оригінальній упаковці для захисту від світла. Не заморожувати.
Зберігати в недоступному для дітей місці.
Повідомлення про виникнення можливих побічних дій
Для моніторингу безпечності вакцини Агентство суспільної охорони здоров'я Канади збирає інформацію про серйозні та неочікувані побічні реакції після вакцинації. Якщо Ви підозрюєте, що у вас виникла серйозна чи неочікувана реакція після вакцинації, повідомте Агентство суспільної охорони здоров'я Канади:
- За безкоштовним телефоном: 1-866-844-0018
- За безкоштовним факсом: 1-866-844-5931
- Електронною поштою: caefi@phac-aspc.gc.ca
- Поштою:
Безпечність вакцин
Центр з імунізації та респіраторних інфекційних захворювань,
Агентство суспільної охорони здоров'я Канади
130 Colonnade Road
Address Locator: 6502A
Ottawa, Ontario K1A 0K9
ПРИМІТКА: Якщо вам потрібна інформація, пов'язана з лікуванням побічних ефектів, що виникли, зверніться до вашого лікаря перед тим як надсилати повідомлення до Агентства суспільної охорони здоров'я Канади. Агентство суспільної охорони здоров'я Канади не надає медичних порад.
Додаткова інформація
Цей документ плюс повний вкладиш до пакунку, підготовлений для медичних працівників, можна знайти за адресою: http://www.gsk.ca або зв'язавшись з автором:
GlaxoSmithKline Inc.
7333 Mississauga Road
Mississauga, Ontario L5N 6L4
1-800-387-7374
Ця інформація підготовлена компанією GlaxoSmithKline Inc.
© 2009 GlaxoSmithKline Inc. Всі права захищені ™AREPANRIX H1N1
Остання редакція: 21 жовтня 2009
Першу версію перекладу цієї інструкції українською мовою було розміщено тут: http://uka-didych.livejournal.com/254520.html
Щиро дякуємо шановній перекладачці за її важку та кропітку працю!
Коментар авторки перекладу:
16 листопаду 2009 3:31
Я перекладала супровідний листок до вакцини Arepanrix від свинячого грипу канадського виробництва, яку зараз реєструють в Україні. І яку рекомендують застосовувати в першу чергу для груп ризику, серед яких діти та вагітні жінки.
Мало того, всі дані про безпечність та ефективність базуються на обмежених клінічних випробуваннях інших "подібних" вакцин з іншим штамом і/або іншою технологією виробництва, а ця вакцина AREPANRIX™ H1N1 пройшла лише, якщо не помиляюся, два маленькі випробування (інші - ледь більше)!
Більш того, ані ця, ні інші "подібні" вакцини не мають жодних даних щодо безпечності для вагітних та плоду, а такі випробування проводилися лише на щурах!
Так ще й ці випробування на щурах показали загрозу плоду!!!
І тим не менше її рекомендують колоти вагітним!!!!!
І це в умовах пандемії сита Канада (зауважте, Канада, а не Гондурас!) дозволяє цю вакцину використовувати для своїх громадян.
Ну нехай, я "маргіналка-сектантка"-антипрививочниця, але серед моїх френдів є розумно-мислячі люди, навіть лікарі.
От скажіть, на Вашу особисту думку, невже цей грип настільки небезпечна хвороба, і ця пандемія настільки загрозлива, що цим можна виправдати такі от безпрецедентні дозволи масово використовувати абсолютно нетестований препарат, зроблений "на коліні"? Я ще можу зрозуміти, якби це була смертельно небезпечна хвороба...
Піарте, поширюйте, читайте, думайте.
А мене, поки я це перекладала, не покидала ще одна думка.
В описі всіх досліджень фігурують в основному 4 вакцини. Дві канадські - одна технологія, і дві німецькі - інша технологія. В кожній групі - два штами - свинячий і ... пташиний.
Пригадується мені, що до вакцинації від "пташиного" грипу так і не дійшло (чи я помиляюся?), а гроші ж в розробку вбухали немалі. А поки йшли клінічні випробування, те да се, вже і паніка тоді вщухла. Судячи з документу, обидві "свиняча" та "пташина" вакцини зроблені за тією ж самою технологією... Я не казатиму, які я висновки зробила. Робіть свої....
ГО "Ліга захисту громадянських прав" поділяє вищенаведені думки та закликає всіх небайдужих громадян не піддаватися паніці щодо "смертельної пандемії" H1N1 і дуже зважено поставитися до питання вакцинації проти цього грипу, як і до будь-якої іншої вакцинації!
| Вложение | Размер |
|---|---|
| arepanrix-vaccin-eng.jpg | 25.39 КБ |





Последние комментарии
4 года 11 недель назад
4 года 24 недели назад
4 года 24 недели назад
5 лет 36 недель назад
5 лет 42 недели назад
6 лет 4 недели назад
6 лет 18 недель назад
6 лет 24 недели назад
6 лет 28 недель назад
6 лет 30 недель назад